Idelalisib bei der Chronischen Lymphatischen Leukämie
Bei der CLL ist Idelalisib zugelassen in Kombination mit Rituximab für Patienten ab der Zweitlinientherapie. Für Patienten mit der prognostisch ungünstigen, genetischen Aberration del(17p13) bzw. TP53-Mutation ist Idelalisib zugelassen, wenn eine Chemoimmuntherapie nicht indiziert ist, also auch in der Erstlinientherapie. Bei Patienten mit follikulärem Lymphom ist Idelalisib ab der Drittlinientherapie zugelassen.
In der Zeit seit der Erstbewertung von Idelalisib durch den G-BA wurden Zwischenergebnisse weiterer, randomisierter Studien bekannt. Sie bestätigen die hohe Wirksamkeit der Substanz, zeigten aber eine erhöhte Todesfallrate in den Idelalisib-Armen bei Einsatz in frühen Therapielinien. Die European Medicines Agency hat dazu eine Überprüfung eingeleitet. Der abschließende Bericht des Pharmacovigilance Risk Assessment Committee (PRAC) wurde am 8. Juli 2016 veröffentlicht [1]. Er bestätigt, dass der Nutzen von Idelalisib die Risiken überwiegt. Er unterstreicht die Einschätzung der EMA vom März 2016, dass unter der Behandlung mit Idelalisib ein erhöhtes Risiko für schwere Infektionen besteht, u. a. für Pneumonien mit Pneumocystis jirovecii, und dass geeignete Vorsichtsmaßnahmen getroffen werden sollen. Eine zwischenzeitlich einschränkende Empfehlung, dass Idelalisib nicht in der Erstlinientherapie von Patienten mit del(17p13) bzw. TP53-Mutation begonnen werden soll, wird in der abschließenden Zusammenfassung des PRAC nicht aufrecht erhalten. Bei Einsatz von Idelalisib in späteren Therapielinien sind diese Komplikationen auch nach längerer Beobachtungszeit nicht aufgetreten.
Die DGHO hatte im ersten Verfahren die Subgruppenbildung und damit auch die Festlegungen der zweckmäßigen Vergleichstherapie (ZVT) kritisiert. Die Definition der Teilpopulationen wurde jetzt geändert. Anforderungen des G-BA, Anträge des pharmazeutischen Unternehmers und die Vorschläge des IQWiG sind in Tabelle 1 zusammengefasst.
Tabelle 1: Berechnungen des Zusatznutzens von pU und IQWiG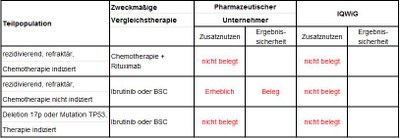
Unsere Anmerkungen sind:
- Die Basis der Nutzenbewertung wurde durch die Daten einer zweiten multizentrischen, randomisierten Studie verbreitert.
- In Kombination mit Anti-CD20 Antikörpern führt Idelalisib gegenüber der jeweiligen Antikörper-Monotherapie zu hochgradigen Steigerungen der Remissionsraten auf 70-85%, zur Verlängerung der progressionsfreien Überlebenszeit mit einem Hazard Ratio von 0,2 sowie zur Verbesserung von Allgemeinzustand und Lebensqualität. In beiden Studien wurde die Überlebenszeit signifikant verlängert.
- Patienten mit der erworbenen, prognostisch ungünstigen genetischen Aberration del(17p13) oder TP53-Mutation profitieren in besonderem Maße von der Therapie mit Idelalisib.
- Ergebnisse randomisierter Studien zum Vergleich von Idelalisib vs. Ibrutinib liegen bisher nicht vor.
- Der G-BA hat als ZVT „Best Supportive Care“ festgelegt. Dem entsprechen die Studienvergleichsarme mit Rituximab- bzw. Ofatumumab-Monotherapie nur eingeschränkt. Da beide Vergleichsarme wirksamer als Best Supportive Care sind, wird der Effekt von Idelalisib unterschätzt.
- Die schweren infektiösen Nebenwirkungen von Idelalisib erfordern eine gezielte antibiotische Prophylaxe und eine engmaschige Überwachung auf Entzündungszeichen.
Idelalisib gehört zusammen mit Ibrutinib und Venetoclax zu den wirksamsten Einzelsubstanzen bei Patienten mit chronischer lymphatischer Leukämie. Eine zuverlässige Quantifizierung des Zusatznutzens ist zum jetzigen Zeitpunkt aufgrund noch nicht vollständig ausgewerteter Ergebnisse weiterer informativer Studien nicht möglich.
Stellungnahme Idealisib (erneute Nutzenbewertung) 2016-07-22