Emicizumab bei der mittelschweren Hämophilie A
Die Zulassung bestand bisher nur für Patienten mit Hämophilie A und einem inhibierenden Antikörper gegen den Faktor VIII sowie für Patienten mit schwerer Hämophilie (FVIII <1%). Emicizumab wurde jetzt auch zugelassen zur Routineprophylaxe bei Patienten mit mittelschwerer Erkrankung (FVIII ≥1% und ≤5%) und schwerem Blutungstyp. Der G-BA hat als zweckmäßige Vergleichstherapie entweder rekombinante oder aus humanem Plasma gewonnene FVIII-Präparate festgelegt, die als Routineprophylaxe eingesetzt werden. Der G-BA hat das IQWiG mit dem Bericht beauftragt. Indikationen, zweckmäßige Vergleichstherapie, Vorschläge vom pharmazeutischen Unternehmer und IQWiG zur Festlegung des Zusatznutzens sind in Tabelle 1 zusammengefasst.
Tabelle 1: Vorschläge zum Zusatznutzen von Emicizumab
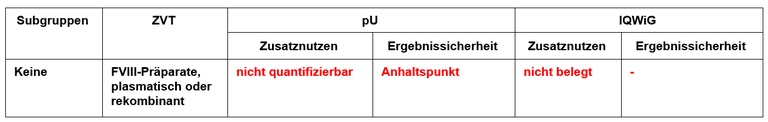
Legende: pU – pharmazeutischer Unternehmer, ZVT – zweckmäßige Vergleichstherapie
Unsere Anmerkungen sind:
- Standard in der Blutungsprophylaxe von Patienten mit mittelschwerer Hämophilie A und schwerem Blutungstyp ist die Verwendung von Plasma-basierten oder rekombinanten FVIII-Präparaten. In den letzten Jahren haben sich zunehmend die Halbwertszeit-verlängerten Präparate in der Versorgung durchgesetzt. Der Einsatz erfolgt entsprechend der Zulassung.
- Basis der frühen Nutzenbewertung von Emicizumab in der Blutungsprophylaxe bei Patienten mit mittelschwerer Erkrankung und schwerem Blutungstyp ist HAVEN 6, eine offene, multizentrische Phase-III-Studie.
- Die annualisierte Blutungsrate lag bei 2,3, die Rate blutungsfreier Patienten bei 33,3%.
- Die Rate schwerer unerwünschter Ereignisse war niedrig.
- Emicizumab wird in der Blutungsprophylaxe regelhaft nicht in Kombination mit FVIII-Präparaten eingesetzt.
Emicizumab ist auch in der Blutungsprophylaxe von Patienten mit mittelschwerer Hämophilie A und schwerem Blutungstyp hoch wirksam und gut verträglich. Mangels vergleichender Daten vor allem gegenüber Halbwertszeit-verlängerten FVIII-Präparaten ist die Quantifizierung eines Zusatznutzens nicht möglich.
