Pembrolizumab in der neoadjuvanten/adjuvanten Therapie des triple negativen Mammakarzinoms
09.11.2022
Die frühe Nutzenbewertung von Pembrolizumab (Keytruda®) ist ein weiteres Verfahren zur Therapie des triple-negativen Mammakarzinoms (TNBC).
Pembrolizumab ist in Kombination mit Chemotherapie zugelassen zur neoadjuvanten und anschließend nach Operation als Monotherapie zur adjuvanten Behandlung des TNBC im frühen Stadium mit hohem Rezidivrisiko oder im lokal fortgeschrittenen Stadium. Der G-BA hat keine Subgruppen gebildet. Das IQWiG wurde mit dem Bericht beauftragt. Pharmazeutisches Unternehmen und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
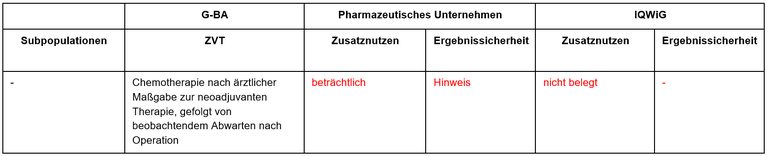
Unsere Anmerkungen sind:
- Die festgelegte, zweckmäßige Vergleichstherapie entspricht den Empfehlungen der Fachgesellschaften.
- Basis der frühen Nutzenbewertung zum Vergleich von Chemotherapie + Pembrolizumab vs Chemotherapie in der neoadjuvanten Therapie des TNBC bei Pat. mit hohem Rezidivrisiko ist die internationale, multizentrische, Placebo-kontrollierte Studie KEYNOTE 522. Basis des Dossiers ist der Datenschnitt vom März 2021. Aktuellere Daten aus dem Datenschnitt vom März 2022 liegen nicht vor.
- Hohes Rezidivrisiko wurde definiert durch die klinischen Stadien T1c N1–2 oder T2–4 N0–2.
- Die Kombination von Chemotherapie mit Pembrolizumab führte gegenüber Chemotherapie zur signifikanten Steigerung der Rate pathohistologischer Komplettremissionen und zu einer signifikanten Verlängerung des ereignisfreien Überlebens. Die Gesamtüberlebenszeit wurde nicht signifikant verlängert, allerdings war die Rate von Ereignissen (erfreulicherweise) zum Zeitpunkt der Auswertung niedrig.
- Die Rate schwerer Nebenwirkungen im CTCAE-Grad 3/4 war im Pembrolizumab-Arm leicht gegenüber dem Kontrollarm erhöht. Die Rate von Therapieabbrüchen war fast doppelt so hoch und lag bei 29,9%. Das zusätzliche Nebenwirkungsspektrum entsprach dem Profil der Immuncheckpoint-Inhibitoren.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Pembrolizumab den Grad A (Skala A (hoch) – C (niedrig)).
- Im IQWiG-Bericht wurden die Nebenwirkungen gegenüber dem Nutzen des ereignisfreien Überlebens aufgerechnet. Der Bericht wurde ohne die Beteiligung von Pat. erstellt. In der Versorgung obliegt die Entscheidung über die Einleitung einer neoadjuvanten und adjuvanten Therapie den Pat. als Ergebnis der partizipativen Entscheidungsfindung.
Die Daten etablieren die Kombination von Chemotherapie und Pembrolizumab als neuen Standard in der neoadjuvanten Therapie von Pat. mit TNBC und hohem Rezidivrisiko.
