Crizotinib in der Zweitlinientherapie des ALK positiven NSCLC
Als zweckmäßige Vergleichstherapie hat der G-BA entweder eine Monochemotherapie mit Docetaxel bzw. Pemetrexed entsprechend dem Kontrollarm der Zulassungsstudie oder Best Supportive Care festgelegt. Der G-BA hat das IQWiG mit der Dossierbewertung beauftragt. Subgruppen, zweckmäßige Vergleichstherapie sowie Anträge und Vorschläge zum Zusatznutzen sind in Tabelle 1 zusammengefasst.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG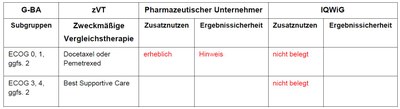
Der IQWiG Bericht kommt zu dem Schluss, dass vor allem die vorgelegten Daten für Patienten im guten ECOG-Stadium nicht geeignet sind, eine Aussage zum Zusatznutzen von Crizotinib zu machen.
Unsere Anmerkungen sind:
- Nach der Zulassung von Crizotinib in der Erstlinientherapie des ALK positiven NSCLC ist der Einsatz von Crizotinib in der Zweitlinientherapie nach platinhaltiger Chemotherapie selten geworden.
- Die zweckmäßige Vergleichstherapie mit Docetaxel oder Pemetrexed entspricht nicht mehr dem vollen Spektrum der Differenzialtherapie.
- Crizotinib steigert die Remissionsrate von 20 auf 65%, die progressionsfreie Überlebenszeit von 3,0 auf 7,7 Monate, und lindert krankheitsbezogene Symptome. Die Nebenwirkungsrate ist niedriger als unter Chemotherapie.
- In der Zulassungsstudie ist die Gesamtüberlebenszeit wegen des Switching von 87% der Patienten aus dem Kontroll- in den Crizotinib-Arm nur eingeschränkt beurteilbar. Eine zusätzliche Sensivitiätsanalyse unter Verwendung des Rank-Preserving Structural Failure Time Modells errechnet eine signifikante Verlängerung der Überlebenszeit mit einem Hazard Ratio von 0,38.
Bei vorbehandelten Patienten mit ALK+ NSCLC ist Crizotinib das Medikament der Wahl in der Zweitlinientherapie.
Crizotinib (Neubewertung nach Fristablauf) DGHO Stellungnahme 20161025.pdf
