Pembrolizumab + Chemotherapie beim NSCLC – gemeinsame Stellungnahmen von DGHO und AIO
Nicht-Plattenepithelkarzinom
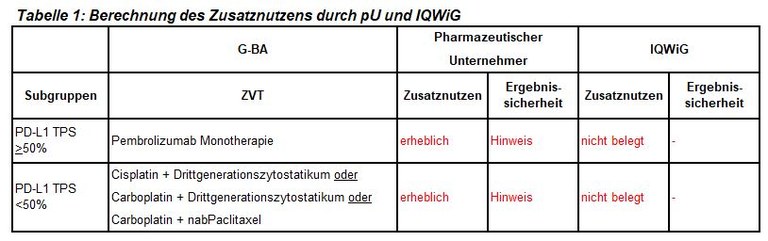
Die frühe Nutzenbewertung von Pembrolizumab ist ein weiteres Verfahren zur initialen Kombinationstherapie bei fortgeschrittenem nichtkleinzelligen Lungenkarzinom (NSCLC), hier bei nicht-plattenepithelialer Histologie. Pembrolizumab ist zugelassen in Kombination mit Pemetrexed und platinhaltiger Chemotherapie zur Erstlinienbehandlung des metastasierenden nicht-plattenepithelialen NSCLC ohne EGFR- oder ALK- positive Tumormutationen. Der G-BA hat zwei Subgruppen zur Festlegung der zweckmäßigen Vergleichstherapie gebildet und das IQWiG mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Unsere Anmerkungen sind:
- Die Subgruppenbildung und die Festlegung der ZVT sind nachvollziehbar. Wir empfehlen als Drittgenerationszytostatikum die Verwendung von Pemetrexed.
- Grundlage der frühen Nutzenbewertung sind KEYNOTE 189, eine Placebo-kontrollierte Phase-III-Studie und die randomisierte, offene Phase-II-Studie KEYNOTE 021G, beide zum Vergleich von Pembrolizumab/Platin/Pemetrexed gegenüber Platin/Pemetrexed.
- Im direkten Vergleich führt die Immunchemotherapie gegenüber der Chemotherapie zu einer Erhöhung der Remissionsrate, zur Verlängerung der progressionsfreien und der Gesamtüberlebenszeit. Der Effekt ist unabhängig von Nachweis und Grad der PD-L1-Expression.
- Die Rate schwerer Nebenwirkungen im CTCAE Grad 3/4 ist in den beiden Studienarmen gleich hoch.
- Bei Patienten mit hoher PD-L1-Expression (TPS >50%) zeigt der indirekte Vergleich gegenüber einer Pembrolizumab Monotherapie auch eine Verlängerung der Gesamtüberlebenszeit gegenüber einer Pembrolizumab Monotherapie. Allerdings ist dieser Vergleich methodisch aufgrund der sehr unterschiedlichen Nachbeobachtungszeiten in den einzelnen Studien sehr kritisch zu bewerten.
• Das Dossier des pharmazeutischen Unternehmers (pU) ist sehr umfangreich, aber unvollständig. Es beschränkt sich auf die Darstellung von Daten, die zur Erlangung eines Zusatznutzens als sinnvoll erachtet werden. Es fehlen die umfassende Darstellung und Analyse zu:- alle Patienten der Zulassungsstudie
Dargestellt werden nur Daten von Patienten, bei denen im Rahmen einer Prüfarztbefragung die Rationale für die Behandlung mit Carboplatin vor Randomisierung erhoben wurde. Dadurch ergeben sich Differenzen mit den publizierten und den Zulassungsdaten. - Progressionsfreies Überleben und Remissionsrate
PFS war koprimärer Endpunkt der Zulassungsstudie. PFS und Remissionsrate sind patientenrelevante Endpunkte, und zum Verständnis der Gründe für eine Verlängerung der Gesamtüberlebenszeit unerlässlich.
Ein großer Wert der frühen Nutzenbewertung liegt in der Datentransparenz. Diese wird hier konterkariert.
- alle Patienten der Zulassungsstudie
- Den Methodikern des IQWiG ist im Dossier des pU eine Diskrepanz bei der Operationalisierung des Endpunkts Gesamtüberleben aufgefallen. Diese scheint im Rahmen der Erstellung des Berichts nicht klärbar gewesen zu sein. Die Analyse der Gesamtüberlebenszeit ist unvollständig, der Vorschlag zum Zusatznutzen vorläufig. Die frühe Nutzenbewertung ist nicht primär eine Arbeitsbeschaffungsmaßnahme für HTA-Institute.
Die Kombination von Pembrolizumab mit Cisplatin/Pemetrexed oder Carboplatin/Pemetrexed (je nach Platinfähigkeit) ist der neue Standard in der Erstlinientherapie des lokal fortgeschrittenen oder metastasierten NSCLC mit nicht-plattenepithelialer Histologie.
Zur vollständigen Stellungnahme
Plattenepithelkarzinom
Die frühe Nutzenbewertung von Pembrolizumab ist ein weiteres Verfahren zur initialen Kombinationstherapie bei fortgeschrittenem nichtkleinzelligen Lungenkarzinom (NSCLC), hier bei plattenepithelialer Histologie. Pembrolizumab ist zugelassen in Kombination mit Carboplatin und entweder Paclitaxel oder nab-Paclitaxel zur Erstlinienbehandlung des metastasierenden plattenepithelialen NSCLC. Der G-BA hat zwei Subgruppen zur Festlegung der zweckmäßigen Vergleichstherapie gebildet und das IQWiG mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1. 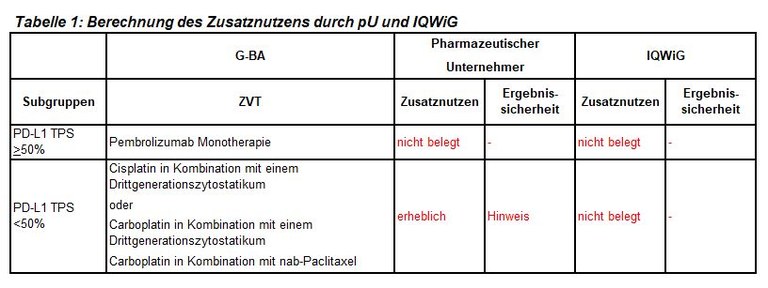
Unsere Anmerkungen sind:
- Bei Patienten mit NSCLC und plattenepithelialer Histologie liegen nur wenige Daten für die Subgruppenbildung auf Basis der PD-L1-Expression mit einer Grenze bei 50% vor. Die Begrenzung der ZVT auf eine Pembrolizumab-Monotherapie bei einem TPS >50% basiert auf geringer Evidenz.
- Grundlage der frühen Nutzenbewertung ist KEYNOTE 407, eine multizentrische, randomisierte, Placebo-kontrollierte Phase-III-Studie zum Vergleich von Pembrolizumab in Kombination mit einer platinhaltigen Chemotherapie plus Paclitaxel/nabPaclitaxel versus der alleinigen Zytostatikatherapie.
- Die Kombinationstherapie führt zu einer Erhöhung der Remissionsrate, zur Verlängerung der progressionsfreien und der Gesamtüberlebenszeit, sowie zur Verzögerung der Zeit bis zur Verschlechterung der körperlichen Funktion.
- Die Rate schwerer Nebenwirkungen im CTCAE Grad 3/4 ist in den beiden Studienarmen gleich hoch, die Rate nebenwirkungsbedingter Therapieabbrüche ist höher im Pembrolizumab-Arm.
- Im Dossier des pharmazeutischen Unternehmers ist der indirekte Vergleich der Überlebenszeiten bei Patienten mit einem TPS >50% methodisch aufgrund der sehr unterschiedlichen Nachbeobachtungszeiten in den einzelnen Studien sehr kritisch zu bewerten.
- Darüberhinaus fehlt im Dossier des pharmazeutischen Unternehmers die umfassende Darstellung und Analyse des koprimären Studienendpunktes progressionsfreies Überleben.
- Den Methodikern des IQWiG ist eine Diskrepanz bei der Operationalisierung des Endpunkts Gesamtüberleben aufgefallen. Entsprechend ist die Analyse der Gesamtüberlebenszeit in dem Bericht unvollständig, der Vorschlag des IQWiG zum Zusatznutzen vorläufig.
Die Kombination von Pembrolizumab mit platinhaltiger Chemotherapie ist ein neuer Standard in der Erstlinie des lokal fortgeschrittenen oder metastasierten NSCLC mit plattenepithelialer Histologie.
Zur vollständigen Stellungnahme