Palbociclib beim HR+ Mammakarzinom
Die erneute Nutzenbewertung von Palbociclib (Ibrance®) beim Hormonrezeptor (HR)-positiven Mammakarzinom findet nach Ablauf der im ersten Verfahren festgelegten Befristung auf 16 Monate statt. Die Neubewertung beschränkt sich auf Patientinnen, die bereits mit einer endokrinen Therapie behandelt wurden. Für die Erstlinientherapie wurde die Befristung der frühen Nutzenbewertung zwischenzeitlich auf 43 Monate, d. h. bis zum 2. Januar 2021, verlängert. Gegenstand dieses Verfahrens ist der Zusatznutzen von Palbociclib in der Zweitlinientherapie des lokal fortgeschrittenen oder metastasierten, HR-positiven, HER2-negativen Mammakarzinoms. Das IQWiG wurde mit dem Bericht beauftragt. Subgruppen, zweckmäßige Vergleichstherapie sowie Bewertungsvorschläge sind in Tabelle 1 zusammengefasst.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG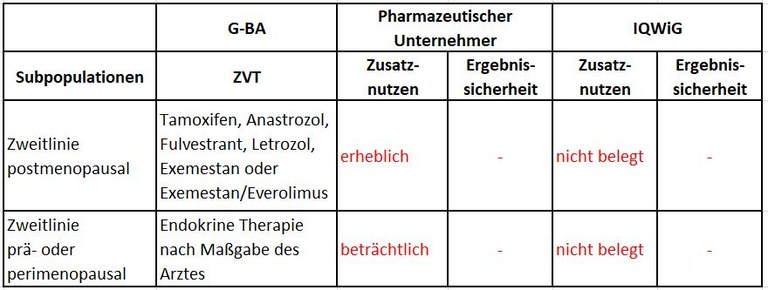
Unsere Anmerkungen sind:
- Basis der frühen Nutzenbewertung ist PALOMA-3, eine internationale, multizentrische, placebo-kontrollierte Phase-III-Studie, zum Vergleich von Fulvestrant + Palbociclib vs Fulvestrant. Die zweckmäßige Vergleichstherapie entspricht den Empfehlungen der Fachgesellschaften. Fulvestrant wird auch in Deutschland entsprechend den Kriterien der Zulassungsstudie eingesetzt.
- Die Neubewertung von Palbociclib unterscheidet sich vom ersten Verfahren im Wesentlichen durch die längere Nachbeobachtungszeit.
- Bei postmenopausalen Patientinnen führt die Kombination von Fulvestrant + Palbociclib gegenüber Fulvestrant zur signifikanten Verlängerung der progressionsfreien Überlebenszeit (Median 5,5 Monate; HR 0,41) und der Gesamtüberlebenszeit (Median 7,7 Monate; HR 0,76). Der Einfluss auf die Gesamtüberlebenszeit wird durch Crossover im Kontrollarm (16%) möglicherweise etwas unterschätzt.
- Bei prä-/perimenopausalen Patientinnen führt die Kombination von Fulvestrant + Palbociclib gegenüber Fulvestrant zur signifikanten Verlängerung der progressionsfreien Überlebenszeit (Median 3,7 Monate; HR 0,44), nicht der Gesamtüberlebenszeit.
- Die Rate schwerer Therapie-assoziierter Neutropenien liegt in beiden Indikationen bei etwa 70%, die Rate febriler Neutropenien bei 1%.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Palbociclib in der Erstlinientherapie den Grad 4 (Skala 1 (niedrig) – 5 (hoch)).
Mit Palbociclib, Ribociclib und Abemaciclib sind inzwischen drei CDK4/6 Inhibitoren zur Kombination mit endokriner Therapie bei Patientinnen mit lokal fortgeschrittenem oder metastasiertem Mammakarzinom in der Zweitlinientherapie zugelassen. Die Kombinationstherapie verbessert die Prognose der Patientinnen. Palbociclib ist der erste CDK4/6 Inhibitor, für den jetzt – nach ausreichend langer Nachbeobachtungszeit – eine Verlängerung der Gesamtüberlebenszeit nachgewiesen wurde. Bei postmenopausalen Patientinnen ist der Effekt gut quantifizierbar, bei den prä-/perimenopausalen Patientinnen ist der Effekt aufgrund der kleinen Patientenzahlen nicht quantifizierbar.
