Stellungnahmen der DGHO zu Pertuzumab adjuvant beim Mammakarzinom und Nivolumab/Ipilimumab beim Melanom
Pertuzumab in der adjuvanten Therapie des HER2+, nodal positiven Mammakarzinoms
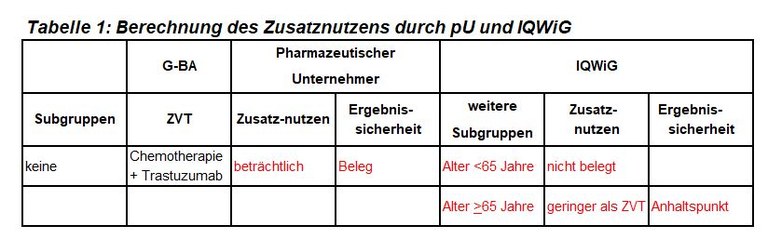
Dieses Verfahren zu Pertuzumab ist das zweite Verfahren zur systemischen Therapie des Mammakarzinoms in kurativer Zielsetzung. Pertuzumab ist zugelassen zur adjuvanten Therapie in Kombination mit Trastuzumab und Chemotherapie bei Patienten mit HER2-positivem Mammakarzinom und hohem Rezidivrisiko. Der G-BA hat Trastuzumab und eine Chemotherapie, bestehend aus einem Taxan (Paclitaxel oder Docetaxel) und ggf. einem Anthrazyklin (Doxorubicin oder Epirubicin), als zweckmäßige Vergleichstherapie festgelegt, und das IQWiG mit der Dossierbewertung beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Unsere Anmerkungen sind:
- Die zweckmäßige Vergleichstherapie entspricht insgesamt dem Stand des Wissens und den Leitlinien.
- Basis der frühen Nutzenbewertung ist APHINITY, eine große internationale, multizentrische, Placebo-kontrollierte Phase-III-Studie bei Patientinnen mit operablem HER2+ Mammakarzinom zum Vergleich von Chemotherapie + Trastuzumab + Pertuzumab versus Chemotherapie + Trastuzumab. Erhöhtes Rezidivrisiko war definiert als Lymphknotenbefall (nodal positiv) oder Hormonrezeptor (HR) negativ.
- Bei nodal positiven Patientinnen führte die Hinzunahme von Pertuzumab zur Verbesserung des krankheitsfreien Überlebens, aber nicht der Gesamtüberlebenszeit. Das krankheitsfreie Überleben ist ein sinnvoller, primärer Endpunkt bei vielen Studien in kurativer Intention.
- Die Rate schwerer unerwünschter Ereignisse lag im Pertuzumab-Arm etwas höher als im Placebo-Arm. Die meisten Nebenwirkungen sind durch die Chemotherapie bedingt. Unter Pertuzumab traten signifikant häufiger Diarrhoen auf.
- Die Daten zur Lebensqualität der Patientinnen zeigen keine Unterschiede.
- Der Vorschlag des IQWiG für eine Altersgrenze bei 65 Jahren ist interessant. Allerdings fehlen eine biologische Rationale und methodische Voraussetzungen. APHINITY war nicht darauf angelegt, einen Unterschied bei jüngeren bzw. älteren Patientinnen nachzuweisen, Alter war kein Stratifikationsmerkmal. Diese Subgruppen-Analyse ist Hypothesen-generierend für zukünftige Studien.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Pertuzumab bei nodal positiven Patientinnen den Grad B (Skala A (hoch) – C (niedrig)).
Die Rezidivrate bei Patientinnen mit HER2-positivem Mammakarzinom ist durch konsequente Gabe adjuvanter Chemotherapie in Kombination mit Trastuzumab erfreulich niedrig. Bei nodal positiven Patientinnen kann sie durch die zusätzliche Gabe von Pertuzumab weiter gesenkt werden.
Nivolumab / Ipilimumab in der Erstlinientherapie des fortgeschrittenen Melanoms
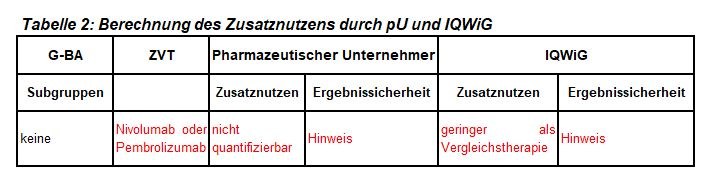
Das Verfahren zu Nivolumab (Opdivo®) in Kombination mit Ipilimumab in der Erstlinientherapie von Patienten mit fortgeschrittenem Melanom und BRAF Wildtyp wird zum dritten Mal durchgeführt, jetzt erneut nach Ablauf der im vorherigen Verfahren gesetzten Frist von 6 Monaten. Der G-BA hat in der Wiederaufnahme des Verfahrens keine Subgruppen zur Festlegung der zweckmäßigen Vergleichstherapie gebildet und das IQWiG mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen der vorliegenden Daten. Einen Überblick über die Subgruppen und die Bewertungsvorschläge gibt Tabelle 2.
Unsere Anmerkungen sind:
- Die zweckmäßige Vergleichstherapie mit einem PD-1/PD-L1-Inhibitor entspricht dem klinischen Standard.
- Gegenüber der letzten Bewertung von 2017 wurden in Ergänzung zu der dreiarmigen Zulassungsstudie 209-067 jetzt auch Daten von 60 Patienten der Phase-I-Studie 209-038 in die Auswertung mit einbezogen.
- In der Gesamtpopulation führt die Kombination Nivolumab/Ipilimumab gegenüber Nivolumab zur Steigerung der Remissionsrate und zur Verlängerung des progressionsfreien Überlebens, nicht der Gesamtüberlebenszeit. Bei Patienten mit BRAF-Wildtyp ist die Remissionsrate gesteigert, progressionsfreies und Gesamtüberleben sind nicht verlängert. Die Auswertung der Gesamtüberlebenszeit wird durch einen vermehrten Einsatz von Ipilimumab in der Postprogressionstherapie des Nivolumab-Arms beeinträchtigt.
- Die Rate von schweren unerwünschten Ereignissen im CTCAE Grad 3/4 liegt unter Nivolumab/Ipilimumab in der Gesamtzulassungsstudie bei 75%, unter Nivolumab bei 45%.
Die Kombination Nivolumab/Ipilimumab ist die wirksamste Therapie beim fortgeschrittenen Melanom. Sie wird in zahlreichen Zentren inzwischen als Standard eingesetzt. Die Nebenwirkungen, insbesondere die Diarrhoe, erfordern ein strukturiertes Management.
Aufgrund der guten Wirksamkeit der Immuncheckpoint-Inhibitoren mit hohen Überlebensraten werden diese Arzneimittel auch bei Patienten mit BRAF V600 Mutation in der Erstlinientherapie eingesetzt. Eine alleinige Nutzenbewertung für Patienten mit BRAF Wildtyp ist nicht sinnvoll.
Unklar ist die Wirksamkeit von Nivolumab beim metastasierten Melanom, wenn Nivolumab bereits in der adjuvanten Situation nach vollständiger Resektion von Lymphknoten- oder Organmetastasen eingesetzt wurde.