Nutzenbewertung von Ibrutinib und Idelalisib bei der Chronischen Lymphatischen Leukämie (CLL)
Ibrutinib in Kombination mit Bendamustin und Rituximab
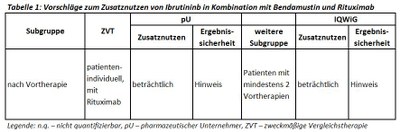
Das erneute Verfahren einer frühen Nutzenbewertung von Ibrutinib (Imbruvica®) bei Patienten mit chronischer lymphatischer Leukämie wird formal im Rahmen des AMNOG wegen des Überschreitens der Umsatzgrenze von € 50 Millionen durchgeführt. Bei vorbehandelten Patienten, d. h. ab der Zweitlinie, ist Ibrutinib als Kombinationspartner mit Bendamustin und Rituximab zugelassen. Der G-BA hat keine Subgruppen gebildet. Als zweckmäßige Vergleichstherapie wurde eine patientenindividuelle Therapie, bevorzugt in Kombination mit Rituximab, festgelegt und das IQWiG mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu gleichen Gesamtbewertungen, im IQWiG-Bericht eingeschränkt auf eine definierte Subpopulation. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Unsere Anmerkungen sind:
- Für die Nutzenbewertung liegen Ergebnisse einer multizentrischen, randomisierten, Placebo-kontrollierten Studie zum Vergleich von Bendamustin/Rituximab/Ibrutinib gegenüber Bendamustin/Rituximab vor.
- Die vom G-BA bestimmte zweckmäßige Vergleichstherapie (ZVT) für vorbehandelte Patienten ist umfassend. Die im Kontrollarm der Zulassungsstudie eingesetzte Kombination Bendamustin/Rituximab kann in der Zweit- und Drittlinientherapie der CLL eingesetzt werden.
- Ibrutinib führte in der Gesamtzulassungsstudie zu einer deutlichen, aber statistisch nicht signifikanten Verlängerung der Überlebenszeit (p=0,06). In der Gruppe der Patienten mit mindestens 2 Vortherapien war der Unterschied statistisch signifikant. Aufgrund einer hohen Switching-( Crossover-) Rate vom Kontroll- in den Ibrutinib-Arm wird der Einfluss von Ibrutinib auf die Gesamtüberlebenszeit möglicherweise unterschätzt.
- Ibrutinib führte sowohl in der Gesamtzulassungsstudie als auch in der Subpopulation der mit mindestens zwei Vortherapien behandelten Patienten zu einer Steigerung der Remissionsrate und zu einer hochgradigen Verlängerung der progressionsfreien Überlebenszeit (jeweils HR 0,2).
- Die mittels validierter Fragebögen erhobenen Parameter der Lebensqualität zeigen keine signifikanten Unterschiede zwischen den beiden Behandlungsarmen.
Die vorliegenden Daten bestätigen die hohe Wirksamkeit und die gute Verträglichkeit von Ibrutinib. Die Dreifachkombination Bendamustin/Rituximab/Ibrutinib ist eine weitere Therapieoption in der Zweit- und Drittlinientherapie der CLL.
Idelalisib in Kombination mit Ofatumumab
Die neue Nutzenbewertung von Idelalisib (Zydelig®) bei Patienten mit chronischer lymphatischer Leukämie (CLL) wird durchgeführt, nachdem auch die Kombination mit dem Anti-CD20-Antikörper Ofatumumab zugelassen wurde. Bisher war nur die Kombination von Idelalisib mit dem Anti-CD20-Antikörper Rituximab zugelassen.
Bei der CLL ist Idelalisib zugelassen in Kombination mit Rituximab oder Ofatumumab für Patienten ab der Zweitlinientherapie. Für Patienten mit der prognostisch ungünstigen, genetischen Aberration del(17p13) bzw. TP53-Mutation ist Idelalisib zugelassen, wenn eine Chemoimmuntherapie nicht indiziert ist, also auch in der Erstlinientherapie.
In der Zeit seit der Erstbewertung von Idelalisib durch den G-BA wurden Zwischenergebnisse weiterer, randomisierter Studien bekannt. Sie bestätigen die hohe Wirksamkeit der Substanz, zeigten aber eine erhöhte Todesfallrate in den Idelalisib-Armen bei Einsatz in frühen Therapielinien. Die European Medicines Agency hat dazu eine Überprüfung eingeleitet. Auf der Basis des abschließenden Berichtes des Pharmacovigilance Risk Assessment Committee (PRAC) [1] hat die EMA bestätigt, dass der Nutzen von Idelalisib die Risiken überwiegt. Es wurden infektiologische Regeln zur Auswahl der geeigneten Patienten und für ihre Überwachung in die Zulassung aufgenommen.
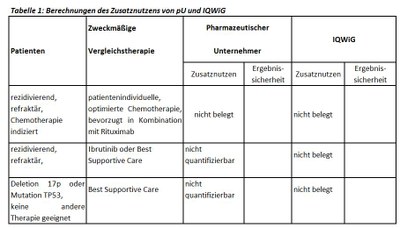
Der G-BA hat die Subgruppenbildung und die Festlegungen der zweckmäßigen Vergleichstherapie aus der letzten Nutzenbewertung von Idelalisib beibehalten, und das IQWiG mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapien und Bewertungsvorschläge gibt Tabelle 1.
Unsere Anmerkungen sind:
- Diese neue Nutzenbewertung von Idelalisib beruht im Wesentlichen auf den Daten von zwei randomisierten Phase-III-Studien. Die Datenlage hat sich seit dem vorhergehenden Verfahren nicht wesentlich geändert.
- In Kombination mit Anti-CD20 Antikörpern führt Idelalisib gegenüber der jeweiligen Antikörper-Monotherapie zu Steigerungen der Remissionsraten und zur Verlängerung der progressionsfreien Überlebenszeit mit einem Hazard Ratio von 0,2. In einer der beiden Studien wurde auch die Gesamtüberlebenszeit signifikant verlängert, wobei dieser Effekt durch eine hohe Switching-Rate möglichererweise noch unterschätzt wird.
- Patienten mit der erworbenen, prognostisch ungünstigen genetischen Aberration del(17p13) oder TP53-Mutation profitieren in besonderem Maße von der Therapie mit Idelalisib.
- Ergebnisse randomisierter Studien zum Vergleich von Idelalisib vs. Ibrutinib liegen bisher nicht vor.
- Der G-BA hat als ZVT „Best Supportive Care“ festgelegt. Dem entsprechen die Studienvergleichsarme mit Rituximab- bzw. Ofatumumab-Monotherapie nur eingeschränkt. Da die Kontrollarme wirksamer als Best Supportive Care sind, wird der Effekt von Idelalisib möglicherweise unterschätzt.
- Die schweren infektiösen Nebenwirkungen von Idelalisib erfordern eine gezielte antibiotische Prophylaxe und eine engmaschige Überwachung auf Entzündungszeichen.
Idelalisib gehört zusammen mit Ibrutinib und Venetoclax zu den wirksamsten Einzelsubstanzen bei Patienten mit chronischer lymphatischer Leukämie. Das Design der Zulassungsstudien war wissenschaftlich korrekt, die Kontrollarme entsprechen aber nicht mehr den heutigen Empfehlungen der Fachgesellschaften. Dadurch ist eine belastbare Quantifizierung des Zusatznutzens auf der Basis dieser Studien nicht möglich.
