Liposomales Daunorubicin/Cytarabin (CPX-351) bei der Therapie-assoziierten AML
18.02.2019
Die frühe Nutzenbewertung von Daunorubicin (lipososomal) / Cytarabin (CPX-351, Vyxeos®) ist das vierte Verfahren zu einem neuen Arzneimittels in der Therapie der neudiagnostizierten akuten myeloischen Leukämie (AML), jetzt beschränkt auf die Subgruppe der Patienten mit sekundärer AML.
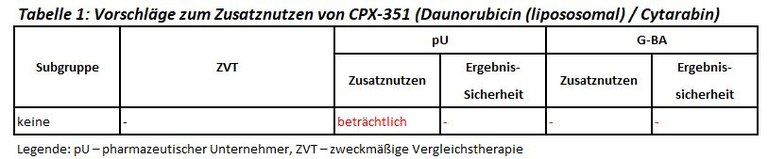
Vyxeos® enthält die fixe Kombination aus zwei Zytostatika. Es ist zugelassen für die Erstlinientherapie von Patienten mit einer neudiagnostizierten AML, die entweder aufgetreten ist in Folge einer vorangegangenen Therapie (therapie-assoziierte AML (t-AML)) oder auf dem Boden eines myelodysplastischen Syndroms (sekundäre AML, s-AML). Der G-BA hat aufgrund des Orphan-Drug-Status den Bericht selbst erstellt. Einen Überblick über die Subgruppen und Bewertungsvorschläge gibt Tabelle 1.
Unsere Anmerkungen sind:
- Basis der frühen Nutzenbewertung von Daunorubicin (lipososomal) / Cytarabin (CPX-351) bei Patienten mit sekundärer AML ist eine multizentrische, in den USA und Kanada durchgeführte, offene Phase-III-Studie bei 309 Patienten im Alter zwischen 60-75 Jahren.
- CPX-351 führt gegenüber der Standardtherapie „7+3“ zu einer Steigerung der Remissionsrate, zu einer Verlängerung des ereignisfreien und des Gesamtüberlebens sowie zu einer Steigerung der Überlebensrate nach 2 Jahren von 12,3 auf 31,3%.
- Die Rate schwerer Nebenwirkungen ist in den beiden Studienarmen gleich. CPX-351 führt aber zu einer deutlichen Verlängerung der Zeit bis zur Regeneration der normalen Hämatopoese. Hierunter kam es nicht zu einem vermehrten Auftreten von infektiösen Problemen oder mehr Blutungen. Die Frühmortalität nach CPX-351 war im Vergleich zur Standardtherapie "7+3" mit 13,7% versus 21,2% bis Tag 60 nummerisch niedriger.
- Daten zur Lebensqualität wurden nicht erhoben.
CPX-351 (Daunorubicin (lipososomal) / Cytarabin) führt zu einer Verbesserung der Prognose von Patienten mit sekundärer AML mit ungünstigen Risikofaktoren.
Zur Stellungnahme
