Vandetanib beim medullären Schilddrüsenkarzinom
Vandetanib ist indiziert für die Behandlung eines aggressiven und symptomatischen medullären Schilddrüsenkarzinoms (MTC) bei Patient*innen mit nicht resektabler, lokal fortgeschrittener oder metastasierter Erkrankung. Die Zulassung gilt für Jugendliche und Kinder im Alter von 5 Jahren und älter. Im ersten Verfahren hatte den Anhaltspunkt für einen geringen Zusatznutzen festgelegt. In der Fachinformation wird auf die Relevanz des RET-Mutationsstatus bei der Interpretation der Daten und der Therapieindikation hingewiesen.
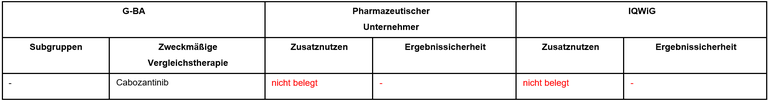
Der G-BA hat das IQWiG mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu identischen Bewertungsvorschlägen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
Unsere Anmerkungen sind:
- Die Festlegung der ZVT entspricht dem Stand der Versorgung und den Empfehlungen der Fachgesellschaften.
- Basis der Zulassung und des ersten Verfahrens der frühen Nutzenbewertung war D4200C00058 (kurz Studie 58), eine randomisierte Placebo-kontrollierte Studie zum Vergleich von Vandetanib versus Placebo. Vandetanib führte zu einer Erhöhung der Ansprechrate, zur Verlängerung der progressionsfreien Überlebenszeit (HR 0,47) und zur Verlängerung der Zeit bis zur Schmerzprogression. Die Gesamtüberlebenszeit wurde nicht verlängert, allerdings war dieser Endpunkt wegen der hohen Zahl von Crossover-Patient*innen nicht zuverlässig beurteilbar.
- Die zusätzlich in diesem Dossier vorgelegten Daten der Studie D4200C00104 (kurz Studie 104) zeigen bei RET-positiven Patient*innen eine Ansprechrate von 41,8% vs 5% bei RET-negativen Patient*innen.
- Die Nebenwirkungen von Vandetanib sind relevant und belastend, aber beherrschbar und generell reversibel.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Vandetanib den Grad 2 (Skala 1 (niedrig) – 5 (hoch)).
Vandetanib gehört zur Standardtherapie bei Patient*innen mit RET-positivem, aggressivem und symptomatischem, medullärem Schilddrüsenkarzinom. Daten zum direkten Vergleich gegenüber Cabozantinib liegen nicht vor.
