Talazoparib beim gBRCA-mutiertem Mammakarzinom
05.10.2020
Die frühe Nutzenbewertung von Talazoparib (Talzenna®) ist das zweite Verfahren zu einem PARP-Inhibitor in der Therapie des fortgeschrittenen oder metastasierten Mammakarzinoms.
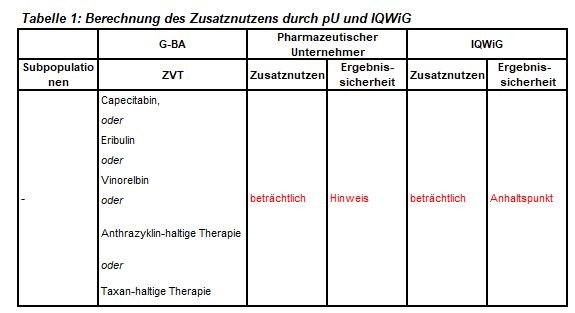
Die Zulassung ist beschränkt auf Patienten* mit HER2 negativem, Keimbahn-BRCA(gBRCA)-mutiertem Mammakarzinom nach Vortherapie mit einem Anthrazyklin und/oder einem Taxan in der (neo-)adjuvanten oder metastasierten Situation. Patienten mit Hormonrezeptor (HR)-positivem Brustkrebs sollten eine endokrin-basierte Therapie erhalten haben. Das IQWiG wurde mit dem Bericht beauftragt. Die etwas unterschiedlichen Bewertungsvorschläge sind in Tabelle 1 zusammengefasst.
Unsere Anmerkungen sind:
- Die zweckmäßige Vergleichstherapie entspricht weitgehend den Empfehlungen der Fachgesellschaften. Die zunehmend häufig eingesetzten Platinderivate sind eine chemotherapeutische Alternative, formal jedoch in dieser Indikation nicht zugelassen.
- Basis der frühen Nutzenbewertung zum Vergleich von Talazoparib vs Chemotherapie nach Wahl des behandelnden Arztes (Capecitabin, Eribulin, Vinorelbin) beim gBRCA-mutierten, fortgeschrittenen/metastasierten Mammakarzinom nach Chemotherapie mit Anthrazyklin und Taxanen ist EMBRACA.
- Talazoparib führt zu einer Steigerung der Remissionsrate, zur Verlängerung des progressionsfreien Überlebens und zur Steigerung der Lebensqualität. Die Überlebenszeit wurde nicht verlängert.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Olaparib den Grad 4 (Skala 1 (niedrig) – 5 (hoch)).
Wir begrüßen, dass Talazoparib nach der EU-Zulassung im Juni 2019 jetzt auch auf dem deutschen Markt eingeführt wurde. Hiermit steht ein weiterer PARP-Inhibitor in einer molekularbiologisch definierten Subgruppe des metastasierten Mammakarzinoms zur Verfügung.
