Apalutamid beim nicht metastasierten, kastrationsresistentem Prostatakarzinom
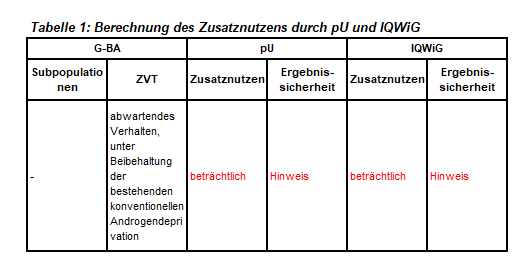
Im ersten Verfahren hatte der G-BA den Anhaltspunkt für einen geringen Zusatznutzen festgelegt. Apalutamid wurde zwischenzeitlich auch für die Therapie metastasiertem, hormonsensitivem Prostatakarzinom (mHSPC) in Kombination mit Androgendeprivationstherapie (ADT) zugelassen. Der G-BA hat keine Subpopulationen gebildet. Das IQWiG wurde mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen auf unterschiedlichen Wegen zu identischen Vorschlägen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Unsere Anmerkungen sind:
- Die Daten entsprechen weitgehend denen der vorherigen Bewertung, neu sind die Daten aus dem Datenschnitt vom Dezember 2019 und die Daten der finalen Analyse zur Mortalität vom Mai 2020.
- Die zweckmäßige Vergleichstherapie entspricht dem bisherigen Standard und den Empfehlungen der Leitlinien.
- Grundlage der frühen Nutzenbewertung ist SPARTAN, eine internationale, multizentrische, randomisierte, Placebo-kontrollierte Phase-III-Studie mit 1.207 Patienten. Die Randomisierung erfolgte 2:1 zugunsten des Verum-Arms.
- Apalutamid + Androgendeprivation (ADT) führt bei Patienten mit nichtmetastasiertem, kastrationsresistentem Prostatakarzinom und einer PSA-Verdopplungszeit <10 Monate im Vergleich mit ADT zu einer signifikanten Verlängerung der Zeit bis zum Auftreten bildgebend nachweisbarer Metastasen, zur Verlängerung der zur symptomatischen Progression und jetzt – nach ausreichend langer Nachbeobachtungszeit - zur Verlängerung der Gesamtüberlebenszeit.
- Die Rate unerwünschter Ereignisse im CTCAE Grad 3/4 liegt im ADT/Apalutamid-Arm bei 45,1%, im ADT/Placebo-Arm bei 34,2%. Häufiger unter Apalutamid wurden arterielle Hypertonie aber auch Verwirrtheit, mentale Veränderungen, Fallneigung, Frakturen und Hautausschläge beobachtet.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Apalutamid in Kombination mit ADT den Grad 3 (Skala 1 (niedrig) – 5 (hoch)).
Mit Apalutamid, Darolutamid und Enzalutamid sind jetzt drei Androgen-Rezeptor-Pathway-Inhibitoren zugelassen. In Kombination mit Androgendeprivation (ADT) bilden sie den neuen Standard bei Patienten mit nichtmetastasiertem, kastrationsresistentem Prostatakarzinom und kurzer PSA-Verdopplungszeit.
Zur Stellungnahme
