Cabozantinib beim hepatozellulären Leberzellkarzinom (HCC)
29.04.2019
Die frühe Nutzenbewertung von Cabozantinib (Cabometyx®) ist das zweite Verfahren der frühen Nutzenbewertung für ein neues Arzneimittel zur systemischen Therapie des hepatozellulären Karzinoms und das erste Verfahren ab der Zweitlinientherapie.
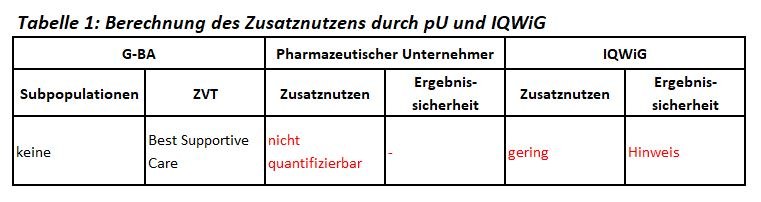
Es ist das dritte Anwendungsgebiet für Cabozantinib nach dem medullären Schilddrüsenkarzinom und dem Nierenzellkarzinom. Cabozantinib ist zugelassen zur systemischen Therapie von Patienten mit fortgeschrittenem und nicht resezierbarem Leberzellkarzinom nach Vorbehandlung mit Sorafenib Das IQWiG wurde mit dem Bericht beauftragt. Subgruppen, zweckmäßige Vergleichstherapie sowie Bewertungsvorschläge sind in Tabelle 1 zusammengefasst.
Unsere Anmerkungen sind:
- Basis der frühen Nutzenbewertung ist CELESTIAL, eine internationale, multizentrische, Placebo-kontrollierte, randomisierte Studie mit 707 Patienten nach Vorbehandlung mit Sorafenib bzw. Unverträglichkeit.
- Die zweckmäßige Vergleichstherapie „Best Supportive Care (BSC)“ entspricht der deutschen Versorgungssituation, nachdem Regorafenib nicht auf dem deutschen Markt zugelassen ist.
- Cabozantinib führt gegenüber Placebo zur Steigerung der Remissionsrate, zur Verlängerung der progressionsfreien und der Gesamtüberlebenszeit.
- Die Rate schwerer unerwünschter Ereignisse ist hoch und liegt bei 68%, allerdings auch bei 36% im Placebo-Arm. Nebenwirkungen sind Substanzklassen-spezifisch. Dosisreduktionen sind häufig.
- Die Erfassung der Lebensqualität ist durch die Beschränkung auf die EQ-5D Skala unvollständig.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Cabozantinib gegenüber Placebo den Grad 3 (Skala 1 (niedrig) – 5 (hoch)).
Mit Cabozantinib steht endlich ein wirksames und zugelassenes Arzneimittel zur Zweitlinientherapie von Patienten mit fortgeschrittenem HCC nach Vorbehandlung mit Sorafenib zur Verfügung.
